Radiation biology with laser-accelerated particles
Les plasmas créés au laser peuvent être utilisés comme moyen d’accélération des particules. Grâce aux gradients d’accélération extrêmement élevés qui se forment dans l’interaction laser-matière à haute intensité, des paquets courts et brillants de rayonnement ionisant (électrons, protons, photons X) sont produits. Ces qualités de rayonnement maintiennent la signature du phénomène d’accélération à leur origine : le taux de répétition initial et la très courte durée.
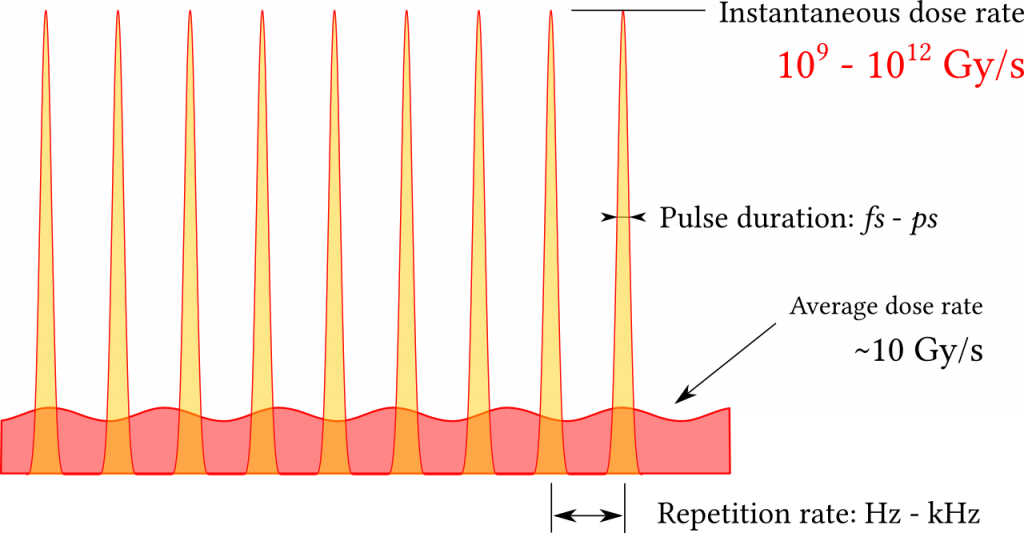

Figure 1 : À gauche : différents phénomènes impliqués dans l’interaction des rayonnements ionisants avec les organismes vivants. A droite : structure temporelle du dépôt de dose par particules accélérées par laser
L’effet biologique des rayonnements ionisants dépend principalement de la dose absorbée, qui est la quantité d’énergie déposée (Gray : joules/kg). Des études récentes ont souligné que non seulement la dose totale déposée mais aussi le profil temporel de son dépôt ont un rôle dans la définition de l’ensemble de l’effet biologique. Cette preuve pourrait être liée au nombre de phénomènes disparates impliqués dans la toxicité des rayonnements ionisants, se déroulant à des échelles temporelles (Fig.1-gauche) et spatiales disparates.
Au LOA, nous utilisons des particules accélérées par laser pour étudier l’effet du dépôt de dose ultra-rapide à des débits de dose ultra-élevés. Cette application directe de particules accélérées par laser nous permet d’explorer l’effet biologique des rayonnements ionisants dans les conditions particulières produites par les sources laser : dose déposée sous forme d’une séquence de flashs de rayonnement ultra-intense et courts (Fig.1-droite).
Des stratégies ad-hoc sont à concevoir et à mettre en œuvre pour transporter et mettre en forme le faisceau accéléré, caractériser précisément son uniformité et sa stabilité et mesurer la dose déposée de manière fiable. Ce point en particulier représente un effort non négligeable car la nature même des faisceaux produits (courte durée, forte intensité) nécessite des protocoles de mesure adaptés et non conventionnels.
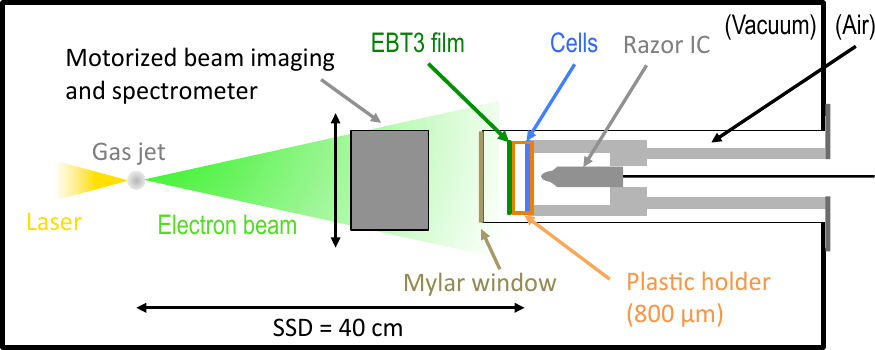
Figure 2 : À gauche : configuration pour une expérience in vitro avec des électrons de faible énergie. À droite : Capsules avec coltures cellulaires
Au cours des dernières années, les protons et les électrons ont été utilisés avec succès pour irradier des monocouches cellulaires. Les tests de survie (Fig.3-droite) sont utilisés comme une confirmation initiale du protocole de dosimétrie mis en œuvre. La fraction survivante des cellules ayant reçu une dose croissante suit généralement une courbe bien connue et reste stable d’une campagne à la suivante.
En faisant varier le délai entre les tirs consécutifs (Fig.3-gauche) à dose déposée constante, nous avons observé une variation de la fraction survivante. Cet effet est la conséquence d’une interaction complexe entre le timing de la fraction de rayonnement et celui des mécanismes de réparation cellulaire qui ont abouti à des conditions d’irradiation plus ou moins toxiques. De plus, deux mutations différentes de la même lignée cellulaire se sont avérées se comporter de manière très différente lors de cette variation. De telles preuves motivent la recherche de protocoles d’irradiation capables d’augmenter la réponse différentielle entre cellules saines et cancéreuses, vers une meilleure compréhension des mécanismes de toxicité et la définition de nouvelles stratégies de traitement du cancer.
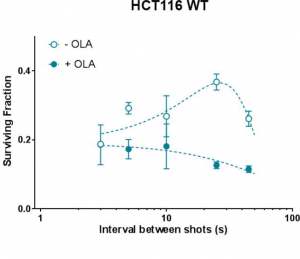
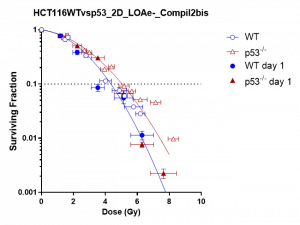
Figure 3 : Gauche : fraction survivante variable des cellules irradiées avec des protons de 7 MeV à dose constante et un délai variable entre les impulsions de commande du laser. A droite : fraction de survie cellulaire après irradiation avec des électrons de 5 MeV
Publications associées:
L.Pommarel et al., “Spectral and spatial shaping of a laser-produced ion beam for radiation-biology experiments,” Phys. Rev. Accel. Beams, vol. 20, no. 3, p. 032801, Mar. 2017, doi: 10.1103/PhysRevAccelBeams.20.032801.
E.Bayart et al., “Fast dose fractionation using ultra-short laser accelerated proton pulses can increase cancer cell mortality, which relies on functional PARP1 protein,” Scientific Reports, vol. 9, no. 1, Dec. 2019, doi: 10.1038/s41598-019-46512-1.
M.Cavallone, A. Flacco, and V. Malka, “Shaping of a laser-accelerated proton beam for radiobiology applications via genetic algorithm,” Physica Medica, vol. 67, pp. 123–131, Nov. 2019, doi: 10.1016/j.ejmp.2019.10.027.
M.Cavallone et al., “Dosimetric characterisation and application to radiation biology of a kHz laser-driven electron beam,” Appl. Phys. B, vol. 127, no. 4, p. 57, Apr. 2021, doi: 10.1007/s00340-021-07610-z.
Contact: Alessandro Flacco
People involved: Alessandro Flacco, Jérôme Faure, Aline Vernier, Lucas Rovige, Joséphine Monzac


